GB 4789.2-2022 菌落总数测定及原始记录参考模板
发布时间:2024-07-19 浏览次数:23
基于较多小型实验室行业同仁对检验项目的一知半解,现分享一篇较全面的菌落总数测定培训教材,喜欢的小伙伴们得赶紧收藏我吆。
标准简介
现行有效的GB4789.2-2022是在2022年12月30号开始实施,在2022年6月30号发布的,与2016版相比,此版标准在检验程序上没有太大的变化,培养基和试剂方面新增了一个菌落总数测试片。
标准解读

检验菌种类:需氧情况下,37℃培养48h,能在普通营养琼脂平板上生长的细菌。不含厌氧或微需氧菌、有特殊营养要求的以及非嗜中温的细菌。也不包括真菌,真菌有单独的检验方法。
菌落总测定是用于判定食品被细菌污染的程度和卫生质量,反应食品在生产过程中是否符合卫生要求。
3 设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:
3.1 恒温培养箱:36℃±1℃,30℃±1℃。
主要为细菌的培养提供恒定的温度
36℃是非水产类产品的培养温度,30℃是水产类的培养温度
3.2 冰箱:2℃~5℃。
用于试剂及菌株的保存
3.3 恒温装置:48℃±2℃。
用于对已灭菌但未用的固体培养基的保温(在此标准上指PCA,在大肠菌群标准上指结晶紫中性红胆盐琼脂)
温度可以在46℃~50℃之间,只要用时温度合适就行
2016版水浴装置:46℃±1℃,2022版修改为恒温装置,这就表示还可以用其他的恒温设备保存,例如恒温干燥箱。
3.4 天平:感量为0.1g。
称取培养基及样品称取,需单独两个天平,一个放准备室,一个放无菌室。
3.5 均质器。
对待检试样液的均质,使试样液的菌含量保持一致,包括匀浆机和拍打式均质器,匀浆机涉及到固体非粉末状样品,拍打式均质器适用于除固体非粉末状样品外的样品

3.6 振荡器。
与均质器作用相仿
3.7 无菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)或微量移液器及吸头。
用于试液转移,微量移液器需定期检定和灭菌,一次性吸头需湿热灭菌处理后烘干水分再使用(买一份移液枪能解放双手哟,就是耗材用得多)
3.8 无菌锥形瓶:容量250mL、500mL。
盛装培养基及试样液,试样液可用均质袋替代
3.9 无菌培养皿:直径90mm。
玻璃培养皿灭菌需放入金属灭菌桶后选用恒温干燥箱171℃灭菌3小时及以上,一次性塑料无菌培养皿拆包装前需紫外杀菌15min以上(有些玻璃培养皿因材质问题,用久会发黄,不影响使用)
3.10 pH计或pH比色管或精密pH试纸。
仅用于自配培养基的pH调节,商用培养基基本上不需要调节pH值
3.11 放大镜或/和菌落计数器。
用于培养后的培养基进行菌落计数
加一个试管和配套试管塞(尺寸15*150mm)
用于盛装9mL稀释液,试管和试管塞需要湿热灭菌处理
4 培养基和试剂
4.1 平板计数琼脂培养基
主要培养基,成分适合细菌进行繁殖
如果是检一批五个样品,大概需要9.4gPCA+400mL水灭菌(以五个样品两个稀释度二十个平板+两个空白对照计算,每个平皿倒15-18mL培养基,用到330mL~396mL。倒培养基倒少了需注意保持培养箱的湿度,不然培养基会裂给你看)
4.2 菌落总数测试片
应符合GB4789.28中平板计数琼脂培养基质量控制要求,且主要营养成分与平板计数琼脂培养基配方一致。
4.3 磷酸盐缓冲液
成分较无菌生理盐水更科学合理,磷酸盐可在适宜范围内调节试样液本身pH,降低因样品本身的pH对实验造成影响,适用于酸类、碱类和高盐类样品的菌落计数。用前需湿热灭菌121℃持续15min(推荐用)
4.4 无菌生理盐水
较磷酸盐缓冲液优势为更易配制。用前需湿热灭菌121℃持续15min
如果是检一批五个样品,大概需要称11.9g氯化钠+1400mL水溶解分装(以225mL五个样品+9mL试管计算,1400mL能配5瓶225mL 0.85%生理盐水和30管9mL 0.85%生理盐水稀释液,能做到-6或-7梯度)磷酸盐缓冲液同理
5 检验程序
菌落总数的检验程序见图1。

6 操作步骤
除样品外所有操作需要使用的试剂耗材,必须灭菌,设备设施可采用紫外杀菌及75%浓度酒精擦拭后使用
6.1 样品的稀释
6.1.1 固体和半固体样品:称取25g样品置于盛有225mL磷酸盐缓冲液或生理盐水的无菌均质杯内,8000r/min~10000r/min均质1min~2min,或放入盛有225mL稀释液的无菌均质袋中,用拍击式均质器拍打1min~2min,制成1∶10的样品匀液。
25g样品:精确到0.1g,偏差25+0.2g,尽量不要偏差太大,可多不可少。
在标准无规定的情况下,最好按25g称样进行实验,这符合GB 4789.1中对抽样遵循代表性原则。当称样数量越少,代表性越差。
225mL稀释液:可使用灭菌后的量筒量取,也可以配制分装好后灭菌直接用(比灭菌后量取劣势为水分灭菌易挥发,导致稀释液浓度改变)。用哪种可自由选择,但特殊样品(酸类、碱类、高盐类)尽量使用磷酸盐缓冲液,避免样品本身pH造成实验误差。
均质器拍打:固体样品可选用均质器均质,使样液混匀;速溶类样品可不用均质器。
1:10样品匀液:1mL样液→9mL试管稀释液=10mL匀液,样液加入后可使用无菌吸管吹打(尽量不用,减少污染),也可摇匀,尽量使液体保持在试管口以下。
6.1.2 液体样品:以无菌吸管吸取25mL样品置盛有225mL磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1∶10的样品匀液。
无菌玻璃珠:用于混匀样液与缓冲液
6.1.3 用1mL无菌吸管或微量移液器吸取1∶10样品匀液1mL,沿管壁缓慢注于盛有9mL稀释液的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用1支无菌吸管反复吹打使其混合均匀,制成1∶100的样品匀液。
沿管壁缓慢注:可能在管壁残留细菌,需要震摇试管,将管壁上的试液混合于匀液中。若使用无菌吸头,可直接垂直于试管将试液打入稀释液中,不靠试管壁,吸头不入液面。
在样品菌落数范围未知/无法通过以往样品判断菌落数范围时,应多做几个稀释度。
6.1.4 按6.1.3操作,制备10倍系列稀释样品匀液。每递增稀释一次,换用1次1mL无菌吸管或吸头。
尽量避免稀释梯度之间的污染
6.1.5 根据对样品污染状况的估计,选择1个~3个适宜稀释度的样品匀液(液体样品可包括原液),在进行10倍递增稀释时,吸取1mL样品匀液于无菌平皿内,每个稀释度做两个平皿。同时,分别吸取1mL空白稀释液加入两个无菌平皿内作空白对照。
根据以往的样品大概的菌含量预估样品的菌含量,适当选择2个~3个稀释梯度,可以选择2个稀释梯度,但必须有1个至2个梯度的菌含量在范围内
例:-1(皿1 皿2) -2(皿1 皿2) 空白(皿1 皿2)
6.1.6 及时将15mL~20mL冷却至46℃~50℃的平板计数琼脂培养基(可放置于48℃±2℃恒温装置如:恒温水浴箱中保温)倾注平皿,并转动平皿使其混合均匀。
平板计数琼脂培养基温度需适宜,以不烫手为宜(水浴箱中拿出的培养基温度适中,可直接使用,无需冷却)。
有些样品为避免白色食物残渣在计数时的影响,会在PCA中加入TTC(各大培养基厂商有售无菌TTC溶液),使培养后的菌落呈红色。此项适用于食物残渣中含白色物质。
转动平皿使其混合均匀:平皿保持同方向,手拿平皿边缘按前后运动、左右运动、顺时针混匀,禁止培养基因大力转动造成溢出,培养基冷凝后方可倒置平皿培养。
本标准未规定称取至倒培养基的过程时间,一旦样品过多,尽量保持在20min之内。(标准没写,GB 4789.3中大肠菌群操作时间是15min,为的是避免过程中因时间过长导致细菌繁殖)
6.2 培养
6.2.1 待琼脂凝固后,将平板翻转,36℃±1℃培养48h±2h。水产品30℃±1℃培养72h±3h。如果样品中可能含有在琼脂培养基表面弥漫生长的菌落时,可在凝固后的琼脂表面覆盖一薄层琼脂培养基(约4mL),凝固后翻转平板,按6.2.1条件进行培养。
倒置平皿培养,温度36℃±1℃,记录温度时需准确,不出现±符号。一般培养箱检定时会提供一个偏差值,需要在原有温度基础上修正偏差量
水产品培养温度比正常的样品要低,主要原因是水产品长期处于水中,生长环境温度较低。
6.2.2 如使用菌落总数测试片,应按照测试片所提供的相关技术规程操作。
6.3 菌落计数
6.3.1 可用肉眼观察,必要时用放大镜或菌落计数器,记录稀释倍数和相应的菌落数量。菌落计数以菌落形成单位(colony-formingunits,CFU)表示。
CFU指单个培养皿的菌落个数。
6.3.2 选取菌落数在30 CFU~300 CFU之间、无蔓延菌落生长的平板计数菌落总数。低于30CFU的平板记录具体菌落数,大于300CFU的可记录为多不可计。每个稀释度的菌落数应采用两个平板的平均数。
6.3.3 其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板作为该稀释度的菌落数;若片状菌落不到平板的一半,而其余一半中菌落分布又很均匀,即可计算半个平板后乘以2,代表一个平板菌落数。
6.3.4 当平板上出现菌落间无明显界线的链状生长时,则将每条单链作为一个菌落计数。

7 结果与报告
7.1 菌落总数的计算方法
7.1.1 若只有一个稀释度平板上的菌落数在适宜计数范围内,计算两个平板菌落数的平均值,再将平均值乘以相应稀释倍数,作为每g(mL)样品中菌落总数结果。
7.1.2 若有两个连续稀释度的平板菌落数在适宜计数范围内时,按式(1)计算:

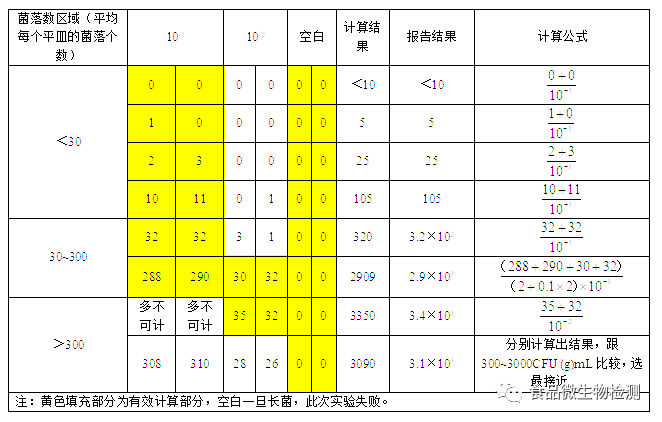
7.1.4 若所有稀释度的平板菌落数均<30CFU,则应按稀释度最低的平均菌落数乘以稀释倍数计算。
7.1.3 若所有稀释度的平板上菌落数均>300CFU,则对稀释度最高的平板进行计数,其他平板可记录为多不可计,结果按平均菌落数乘以最高稀释倍数计算。
7.1.5 若所有稀释度(包括液体样品原液)平板均无菌落生长,则以小于1乘以最低稀释倍数计算。
7.1.6 若所有稀释度的平板菌落数均不在30CFU~300CFU 之间,其中一部分<30CFU 或>300CFU 时,则以最接近30CFU或300CFU的平均菌落数乘以稀释倍数计算。
7.2 菌落总数的报告
7.2.1 菌落数小于100CFU 时,按“四舍五入”原则修约,以整数报告。
菌落数指计算后的结果,即公式(1)中的N
例如计算结果为35CFU/(g)mL,则报35CFU/(g)mL,不需要再修约。
7.2.2 菌落数大于或等于100CFU 时,第3位数字采用“四舍五入”原则修约后,取前2位数字,后面用 0代替位数;也可用10的指数形式来表示,按“四舍五入”原则修约后,采用两位有效数字。
例如计算结果为3540,则报3500CFU/(g)mL或3.5×103CFU/(g)mL
7.2.3 若空白对照上有菌落生长,则此次检测结果无效。
空白对照长菌,证明环境/试剂/工具有污染。
此条可理解为当空白对照没长菌落时,可以用“未检出”表示
7.2.4 称重取样以 CFU/g为单位报告,体积取样以 CFU/mL为单位报告。
附录A
培养基和试剂
A.1 平板计数琼脂(platecountagar,PCA)培养基

A.1.2 制法
将上述成分加于蒸馏水中,煮沸溶解,调节 pH 至7.0±0.2。分装试管或锥形瓶,121 ℃高压灭菌 15min。
有商品化脱水培养基,不用自行调节pH,可直接使用,有效避免自配产生的误差。
其中样品为白色或偏白色时,培养基中可添加1%的无菌TTC进行菌落着色,着色后菌落为红色。
煮沸溶解:适用于自配培养基,商品化脱水培养基可不进行此操作(灭菌前需分装的培养基除外)
A.2 磷酸盐缓冲液

贮存液:称取34.0g的磷酸二氢钾溶于500mL蒸馏水中,用大约175mL的1mol/L氢氧化钠溶 液调节pH 至7.2,用蒸馏水稀释至1000mL后贮存于冰箱。
A.2.2 制法
稀释液:取贮存液1.25 mL,用蒸馏水稀释至1000mL,分装于适宜容器中,121 ℃高压灭菌15min。
有商品化脱水培养基,直接使用,有效避免自配产生的误差。
A.3 无菌生理盐水

A.3.2 制法
称取8.5g氯化钠溶于1000mL蒸馏水中,121 ℃高压灭菌15min。
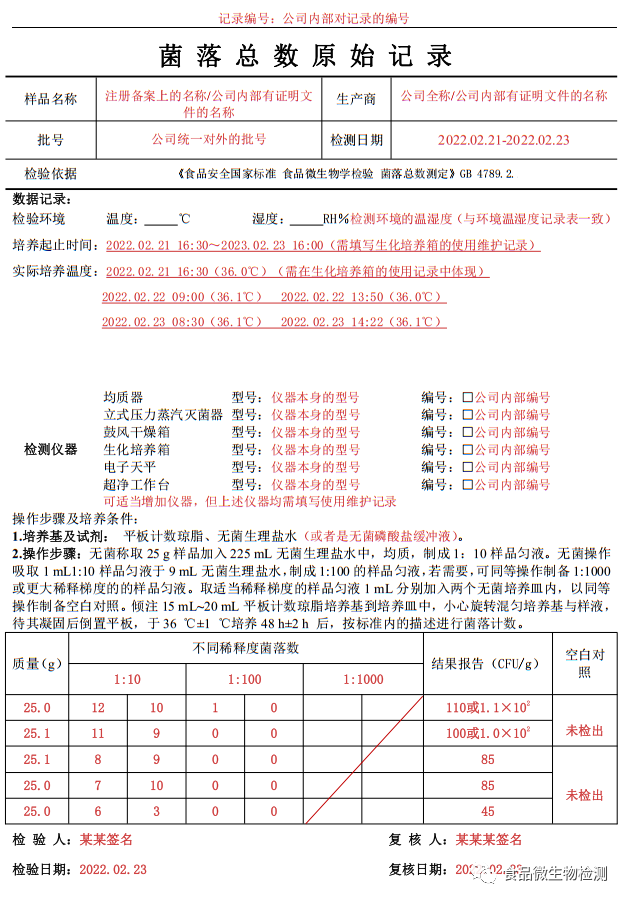
菌落总数原始记录参考模板
参考资料:
1. GB 4789.2-2022 食品安全国家标准 食品微生物学检验 菌落总数测定
2.中华人民共和国卫生健康委员会官网
3.T/LZZLXH 033-2020 实验室产品检测全流程记录管理指南
4.DB51/T 2163-2016 实验室样品记录及检测记录管理指南
5.微生物检验方法食品安全国家标准实操指南
6.《寒烟脆》公众号文章(2022年4月30日)





