实验干货 | 原代细胞分离培养(小鼠结肠细胞为例)
发布时间:2024-02-22 浏览次数:253
01 简介
原代细胞分离培养是一项实验技术,它涉及从生物体中提取组织或细胞,并将它们转移到体外环境中进行培养。这些来源包括各种组织器官、外周血和胚胎等。在培养过程中,原代细胞的生长速度相对较慢,通常在培养的前10代内停止生长。因此,通常将培养的细胞归类为原代细胞培养,这些细胞包括第1到第10代的细胞。
原代细胞保持了体内原始细胞的生物学特性,最接近于体内的生长特性。因此,它们为研究生物体细胞的生长、代谢和繁殖提供了有力的工具。此外,原代细胞培养还为精准医疗的肿瘤诊治模式和个体化精准用药提供了支持。
常见的原代细胞类型包括上皮细胞、内皮细胞、成纤维细胞、角质形成细胞、黑色素细胞、神经元、星形胶质细胞、肝细胞、骨骼肌细胞、平滑肌细胞、成骨细胞、肌细胞、软骨细胞、脂肪细胞、滑膜细胞、毛细胞、血细胞和干细胞。
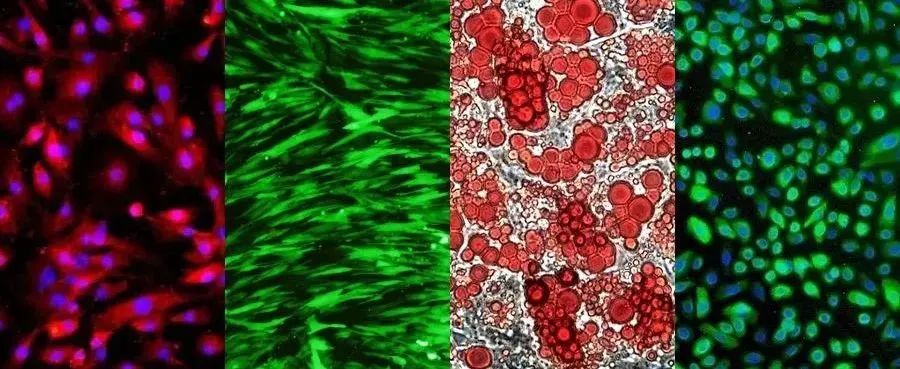
02 实验原理
在原代细胞分离培养中,首先从动物体内取出各种组织,然后采用不同的方法,如酶消化(通常使用胰蛋白酶/胶原酶)、螯合剂(通常是EDTA)或机械分散,将组织分散成单个细胞。这些单细胞被放置在适当的培养基中进行培养,以在离体环境中存活、生长和繁殖。这个过程称为原代培养,主要包括取材、分离和培养三个步骤。
以小鼠结肠细胞为例,为了提高目标细胞的纯度,原代提取的细胞通常与其他细胞混合。通过采用生物酶梯度消化和差速贴壁等方法,可以获得纤维组织和上皮组织的高纯度目标细胞。具体地,使用胶原酶 I 和分散酶 II 消化结肠组织可分散细胞间质,而差异消化和差速贴壁方法则能有效去除成纤维细胞,最终获得高度纯净的结肠上皮细胞。
03 材料与仪器
含有双抗的DMEM培养基、5 g/L胰蛋白酶、Buffer溶液(5% RPMI1640 + 5% FBS + 10mM HEPES)、消化液(DMEM培养基溶解胶原酶I浓度为 0.1%,分散酶II浓度为 0.3%)、无菌剪刀、无菌镊子、100 μm 细胞过滤器、细胞培养瓶、细胞培养板。
04 实验步骤
1. 通过使C57BL/6小鼠颈椎脱臼死亡,然后用适量的酒精喷洒和Buffer滴加的方式,快速分离结肠。
2. 沿着肠系膜进行剪开,利用DMEM培养基清洗结肠,以去除其中的肠腔内容物。
3. 使用无菌剪刀将结肠组织剪成约1mm3大小的碎片。
4. 使用10 mL 0.1%胶原酶I和3%分散酶II对组织进行消化,在37℃的摇床上消化25分钟。
5. 进行吹打混匀,并通过100μm细胞过滤器过滤,以收集上清液。
6. 采用相差消化法和差速贴壁法去除成纤维细胞。
7. 加入1 mL培养基,将细胞悬浮后接种于含有完全培养基的培养瓶中,在37℃、5% CO2的细胞培养箱中培养。
8. 当细胞生长至培养瓶的80-90%时,使用5 g/L胰酶消化液进行消化,然后将其接种于细胞培养板中。
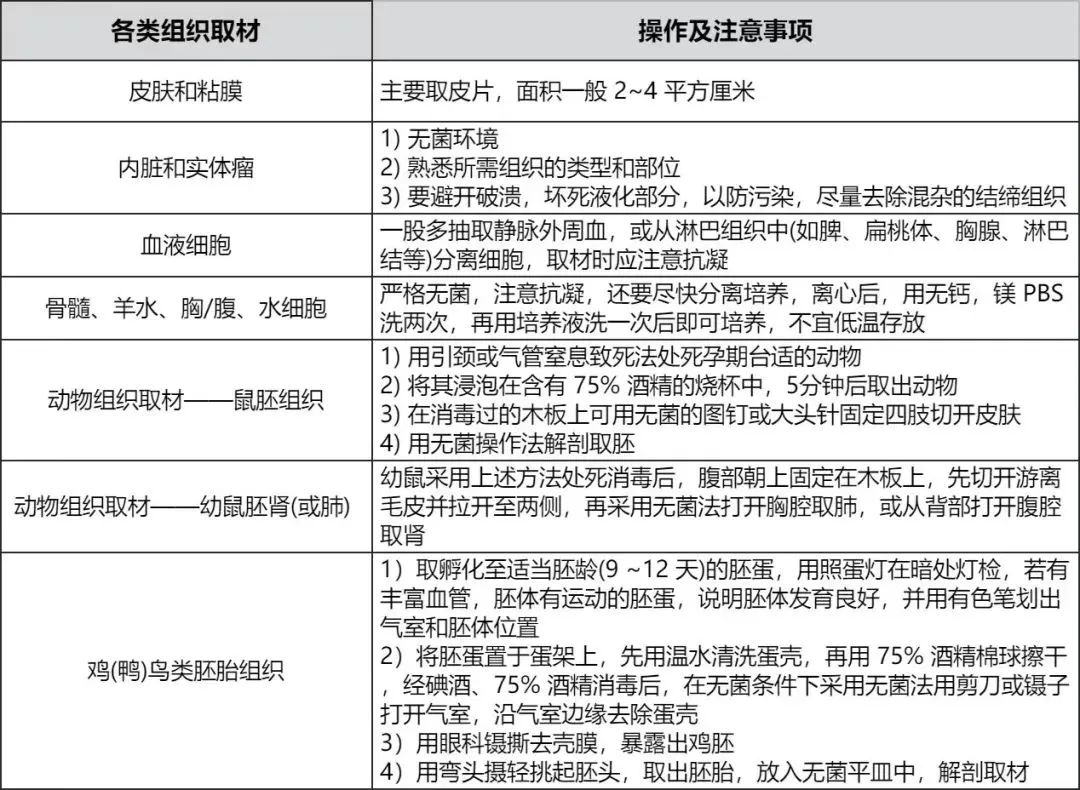
05 「原代培养」注意事项与常见问题
1.注意事项
原代细胞培养具有较高的成本,并对培养条件有严格要求。因此,在培养过程中需要特别注意保持无菌环境,并尽可能去除目标细胞以外的其他细胞。
1.在实验开始前,必须对所有器械进行消毒处理,并进行高压灭菌,液体则需要进行无菌过滤处理。
2.酶消化液必须立即现用现配,以确保其活性。
3.在实验过程中,需要充分消化组织以确保检测到足够数量的细胞。
4.同时,也要尽可能充分去除成纤维细胞。
5.在后续的培养过程中,必须保持全程无菌操作,以确保培养环境的纯净性。
3.常见问题
Q: 保存血清最好的方法是什么?
A: 建议将血清存放在 -5℃ 至 -20℃的温度范围内。如果存放在4℃,请不要超过一个月。如果无法一次使用完整瓶血清,建议将血清经过无菌分装后存放在适当的灭菌容器中,然后再放回冷冻。
Q: 如何解冻血清以保持其最佳培养状态?
A: 建议将血清从冷冻箱中取出后,首先放置在2~8℃的冰箱中使其融化,然后在室温下使其完全融化。但务必要注意,在融解过程中必须规律地摇晃以确保均匀。
Q: 血清解冻后发现有絮状沉淀物出现,应该如何处理?
A: 血清中出现沉淀物有很多原因,但最常见的是由于血清中脂蛋白的变性所致。此外,血清解冻后血纤维蛋白的存在也可能导致沉淀物的生成。

说明:环凯转载于“誉嘉医学”公众号,内容版权归原作者所有;
提醒:文章、图片等所有内容,仅用于学习交流,若有侵权内容及其他涉法内容,请及时联系删除或修改。特此声明!





